Электронные плакаты предназначены для демонстрации преподавателем дидактического материала на занятиях, с использованием:
- интерактивной доски;
- мультимедийного проектора;
- иных компьютерных демонстрационных комплексов.
В отличие от обычных электронных учебников, данные презентации разработаны специально для показа рисунков, схем, таблиц на лекциях.
Удобная программная оболочка имеет оглавление, позволяющее просмотреть необходимый плакат.
Предусмотрена защита плакатов от несанкционированного копирования.
В помощь преподавателю для подготовки к занятиям прилагается печатное пособие.
Ниже представлен состав диска c электронными плакатами.
Перечень электронных плакатов по разделу общая химия:
(Кликните для предварительного просмотра или скачайте все)
Раздел 1. Основные понятия химии
- Молярные массы и молярные объемы некоторых веществ
- Разложение воды электрическим током
- Закон сохранения массы вещества
- Типы химических реакций
- Генетическая связь классов неорганических соединений
Раздел 2. Строение атома
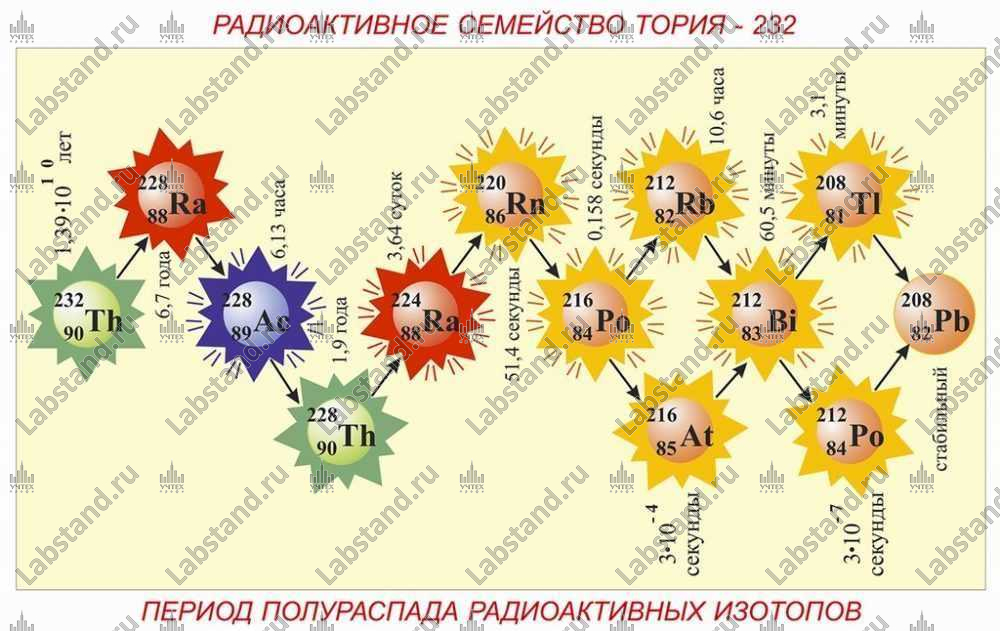
- Радиоактивное семейство тория-232
- Отклонение α, β и γ лучей в электрическом поле
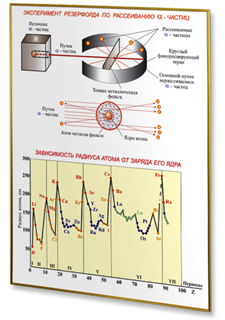
- Эксперимент Резерфорда по рассеиванию α-частиц
- «Мысленные» фотографии атома водорода, полученные через равные промежутки времени
- Серия линий Бальмера в спектре атомарного водорода
- Схема дискретных энергетических уровней в атоме водорода
- Электронная плотность 1s- и 2s-орбиталей
- Конфигурация атомных орбиталей и ориентация их в пространстве
- Радиальное распределение вероятности нахождения электрона (электронной плотности) на расстоянии r от ядра
- Взаимное проникновение орбиталей 1s, 2s, 3s
- Взаимное проникновение орбиталей 3s, 3p, 3d
- Последовательность заполнения атомных орбиталей электронами
- Порядок заполнения атомных орбиталей электронами
- Строение атомов s-элементов I периода и s- и p-элементов II периода
- Схема устройства масс-спектрометра и масс-спектр атома хлора
Раздел 3. Периодический закон и периодическая система элементов Д. И. Менделеева
- Периодическая система элементов Д. И. Менделеева
- Рентгеновские спектры атомов элементов и графическая интерпретация закона Мозли
- Устройство рентгеновской трубки
- Радиусы атомов металлов (s-, p-, d-элементов), пм
- Орбитальные радиусы нейтральных атомов, пм
- Зависимость радиуса атома от заряда его ядра
- Изменение атомных радиусов в ряду лантаноидов
- Энергии ионизации (I) атомов элементов II и III периодов
- Зависимость энергии ионизации (I) от заряда ядра атома
- Сродство к электрону (Еср) атомов некоторых элементов, кДж/моль
- Сродство к электрону атомов элементов II и III периодов
- Относительная электроотрицательность атомов элементов по Полингу
- Свойства атомов элементов IA и VIIА групп
- Свойства атомов элементов IIIА и IVА групп
- Свойства атомов элементов IIIБ, IVБ и IБ групп
- Истинные и эффективные заряды ядер нейтральных атомов
Раздел 4. Химическая связь и строение молекул
- Образование химической связи между атомами водорода
- Силы, возникающие при взаимодействие электронов с ядрами двух атомов А и В
- Различные виды σ–связи между атомами А и В
- Различные виды π-связи между атомами А и В
- Гибридизация валентных орбиталей
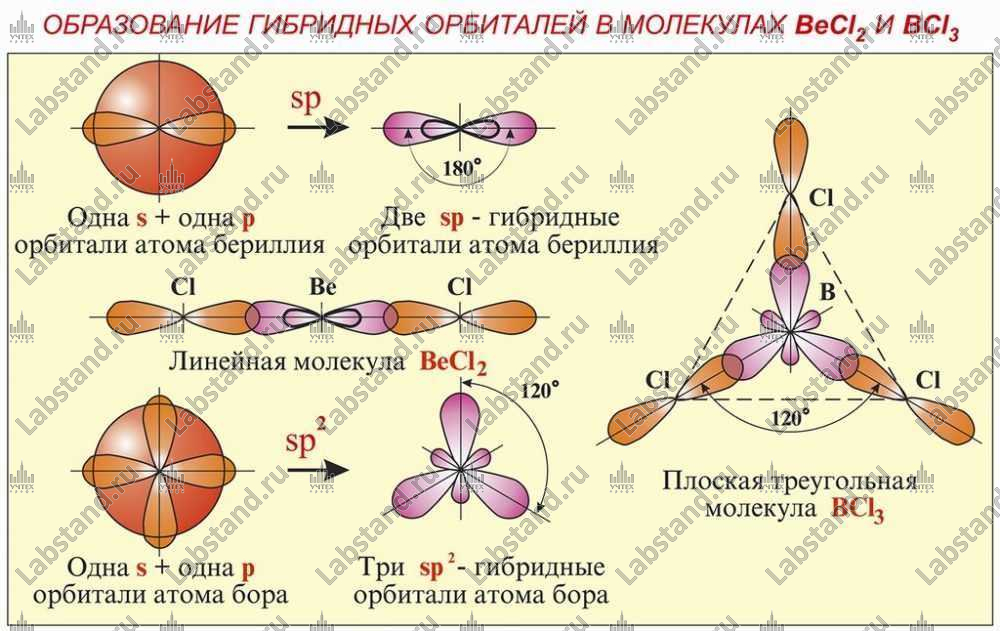
- Образование гибридных орбиталей в молекулах BeCl2 и BCl3
- Образование иона аммония
- Взаимосвязь разности электроотрицательностей и степени ионности связи
- Энергия диссоциации и длина некоторых химических связей
- Дипольные моменты некоторых связей
- Дипольные моменты некоторых молекул
- Распределение вероятности нахождения электронов вдоль межъядерной оси и образование связывающих и разрыхляющих молекулярных орбиталей
- Молекулярные δs-орбитали
- Молекулярные δPx-орбитали
- Молекулярные πPy,z-орбитали
- Свойства гомоядерных молекул и молекулярных ионов, образованных элементами I периода
- Свойства гомоядерных молекул, образованных элементами II периода
- Свойства некоторых молекул и молекулярных ионов, образованных элементами II периода
- Валентные углы и строение молекул водородных соединений элементов VA группы
- Валентные углы и строение молекул водородных соединений элементов VIA группы
- Число локализованных электронных пар (ЛЭП) центрального атома и пространственная конфигурация молекул АВn
- Число локализованных электронных пар (ЛЭП) центрального атома и пространственная конфигурация молекул АВn (продолжение)
- Типы межмолекулярного взаимодействия
- Элементарные ячейки ионных решеток кристаллов (NaCl и CsCl)
- Ковалентные кристаллы (графит и алмаз)
- Ковалентные кристаллы (йод и йодид кадмия)
- Структура кристаллического HF
- Различные типы кристаллической упаковки металлов (трехмерное изображение)
- Структура и свойства твердых веществ
- Кинетические представления о различных физических состояниях веществ
- Энергии некоторых кристаллических решеток (Т = 298 К)
- Положение полупроводников (простые вещества) в периодической системе элементов Д. И. Менделеева.
- Зависимость электропроводности полупроводника и металла от температуры
- Возникновение энергетических зон в кристаллах
- Схема энергетических зон
- Строение комплексных соединений. Классификация комплексных соединений по типу лигандов
- Изомерия комплексных соединений
- Расщепление d-орбиталей в октаэдрическом поле лигандов. Атомные орбитали dx2-у2 и dxy в октаэдрическом поле лигандов
- Расщепление d-орбиталей в тетраэдрическом поле лигандов. Атомные орбитали dx2-у2 и dxy в тетраэдрическом поле лигандов
- Расщепление d-орбиталей иона Со3+ в октаэдрических комплексах [CoF4]3– и [Co(NH3)4]3+
- Энергетический переход у комплексообразователя [Ti(H2O)6]3+ при поглощении квантов видимого света и полоса поглощения в видимой части спектра
Раздел 5. Растворы
- Классификация дисперсных систем
- Термодинамика процесса растворения
- Кристаллическая структура льда и структура жидкой воды
- Водородные связи между молекулами воды в кристалле льда
- Зависимость плотности и удельного объема льда и воды от температуры
- Некоторые физические свойства воды в сравнении с другими растворителями
- Диаграмма состояния воды
- Температура плавления и кипения гидридов неметаллов элементов главной подгруппы VI группы
- Зависимость давления насыщенного пара от температура над чистым растворителем и над раствором (С2 > C1)
- Классификация истинных растворов
- Способы выражения состава растворов
- Способы выражения концентрации растворов (массовая доля)
- Способы выражения концентрации растворов (молярная доля)
- Способы выражения концентрации растворов (молярная концентрация вещества)
- Способы выражения концентрации растворов (молярная концентрация эквивалентов)
- Способы выражения концентрации растворов (титр раствора)
- Способы выражения концентрации растворов (моляльность)
- Соотношения между различными способами выражения состава растворов
- Растворимость солей, кислот и оснований в воде (табл. растворимости)
- Состояние сильных и слабых электролитов в растворе
- Растворение и гидратация молекул сахара в воде
- Растворение и диссоциация ионного кристалла
- Растворение, ионизация и диссоциация полярных молекул
- Растворимость некоторых веществ в воде
- Кривые растворимости некоторых твердых веществ в воде
- Зависимость растворимости некоторых газов в воде от температуры
- Реакции обмена в растворах электролитов, идущие с образованием слабого электролита, на примере реакции: HCl + NaOH ® NaCl + H2O
- Реакции обмена в растворах электролитов, протекающие с образованием малорастворимого вещества, на примере реакции: Na2SO4 + BaCl2 ® BaSO4¯ + 2NaCl
- Реакции обмена в растворах электролитов, протекающие с образованием газообразного вещества, на примере реакции: 2HCl + Na2S ® H2S + 2NaCl
- Шкала значений pH и окраска некоторых индикаторов
- Ионное произведение воды (Кв) при различных температурах
- Окраска некоторых индикаторов в различных средах
- Окраска универсального индикатора в растворах с различными значениями pH-среды
- Значения pH некоторых растворов
- Степень электролитической диссоциации некоторых электролитов (С = 0,1 моль/л)
- Константы диссоциации некоторых электролитов (Т = 298 К, С = 0,1 моль/л)
- Произведения растворимости некоторых малорастворимых электролитов
- Сила кислородсодержащих кислот
- Осмотическое давление
- Классификация грубодисперсных и коллоидных систем
- Криоскопические константы
- Эбуллиоскопические константы
- Строение коллоидной мицеллы
- Строение геля и золя
- Эффект Тиндаля
Раздел 6. Окислительно-восстановительные реакции и общие понятия электрохимии
- Степень окисления (СО)
- Распространенные окислители и восстановители
- Методы составления уравнений окислительно-восстановительных реакций (метод электронного баланса)
- Методы составления уравнений окислительно-восстановительных реакций (метод электронно-ионного баланса)
- Гальванический элемент и схема его работы
- Стандартные потенциалы некоторых металлических электродов в водных растворах при 298 К
- Схема стандартного водородного электрода (H2, Pt/H+). Измерение электродных потенциалов металлов относительно стандартного водородного электрода
- Стандартные потенциалы некоторых окислительно-восстановительных электродов при 298 К
- Виды коррозионных разрушений и механизм электрохимической коррозии углеродистой стали в кислой и нейтральной средах
- Электролиз расплава и водного раствора соли NaCl
- Потенциалы водородного и кислородного электродов при различных условиях
- Перенапряжение выделения водорода и кислорода на различных электродах при t = 250 °C и i = 10 А/м2
Раздел 7. Химическая кинетика и химическое равновесие
- Изменение во времени концентрации реагентов в системе: 2HI « H2 + I2 (Т = 720 К)
- Поверхностный слой адсорбента
- Наиболее распространенные катализаторы в гетерогенном катализе
- Гетерогенное равновесие при разложении CaCO3
- Энергетическая диаграмма разложения перекиси водорода
Раздел 8. Химическая термодинамика
- Пути превращения исходных веществ в продукты реакции
- Энергетические диаграммы экзотермической и эндотермической реакций
- Изменение энтальпии реакции горения метана
- Определение теплового эффекта при постоянном объеме
- Стандартные теплоты фазовых переходов некоторых веществ (Т = 298 К)
- Стандартные энтальпии образования (Р = 1 атм, Т = 298 К)
- Стандартные энтальпии образования некоторых ионов в водных растворах
- Цикл Борна — Габера для оксида магния
- Цикл Борна — Габера для хлорида натрия
- Работа расширения газа при постоянном давлении
- Примеры колебательного и вращательного движения молекул воды
- Расширение инертного газа в свободное пространство
- Изменение в степени упорядоченности при растворении ионного кристалла в воде
- Зависимость энтропии свинца от температуры
- Изменение стандартных энтропий в зависимости от порядкового номера элементов в периодической системе Д. И. Менделеева (Р = 1 атм, Т = 298 К)
- Стандартные энтропии некоторых веществ (Р = 1 атм, Т = 298 К)
- Зависимость энергии Гиббса от состава химической системы.
- Изменение энергии Гиббса в необратимом процессе
- Стандартные энергии Гиббса (Р = 1 атм, Т = 298 К)
- Диаграммы реакций образования некоторых оксидов
- Влияние температуры на самопроизвольное протекание реакций
Раздел 9. Методы промышленного получения веществ и их применение
- Получение и применение алюминия. Промышленный электролизер для выплавки алюминия.
- Вакуумный ковш для извлечения алюминия из электролизера. Связь применения алюминия с его свойствами
- Доменное производство
- Производство стали. Кислородно-конверторный способ. Производство стали в электропечах. Мартеновская печь
- Производство аммиака. Схема промышленного получения азотной кислоты
- Основные области применения аммиака и азотной кислоты
- Основные области применения фосфора и его соединений
- Основные области применения углерода и его соединений
- Основные области применения кремния и его соединений
- Основные области применения кальция и его соединений
- Основные области применения серы
- Производство серной кислоты. Основные области применения оксида серы (IV) и серной кислоты
- Основные области применения галогенов и их нахождение в природе
Раздел 10. Органическая химия
- Классификация органических соединений
- Номенклатура органических соединений
- Структурная изомерия
- Пространственная изомерия
- Образование гибридных орбиталей в молекуле CH4
- Предельные углеводороды — алканы (CnH2n+2)
- Химические свойства алканов
- Реакция замещения в алканах (SR)
- Реакция замещения в алканах (SE)
- Образование химических связей в молекуле этилена H2C = CH2
- Непредельные углеводороды алкены (CnH2n)
- Химические свойства алкенов
- Цепной ионный механизм реакции присоединения к алкенам
- Цепной радикальный механизм реакции присоединения к алкенам
- Образование химических связей в молекуле бутадиена-1,3
- Диеновые углеводороды (CnH2n–2)
- Образование химических связей в молекуле ацетилена HC ≡ CH
- Непредельные углеводороды алкины (CnH2n–2)
- Химические свойства алкинов
- Циклоалканы (CnH2n)
- Химические свойства циклоалканов
- Образование химических связей в молекуле бензола
- Ароматические углеводороды (CnH2n–6)
- Химические свойства аренов
- Реакции электрофильного замещения (Se) в бензольном ядре
- Заместители I рода и их ориентирующее влияние в реакциях Se
- Заместители II рода и их ориентирующее влияние в реакциях Se
- Сравнительная характеристика строения и свойств углеводородов
- Галогенопроизводные углеводороды
- Спирты
- Химические свойства спиртов
- Механизм реакции нуклеофильного замещения в молекулах спиртов
- Механизм реакций элиминирования E1 и E2
- Фенолы
- Химические свойства фенола
- Альдегиды
- Химические свойства альдегидов
- Кетоны
- Механизм реакции нуклеофильного присоединения
- Карбоновые кислоты
- Карбоновые кислоты
- Химические свойства карбоновых кислот
- Механизм реакции этерификации
- Эфиры
- Углеводы
- Углеводы
- Нитросоединения
- Амины
- Химические свойства анилина
- Аминокислоты
- Свойства аминокислот
- Структура белков
- Гетероциклические соединения
- Механизм реакции полимеризации
- ВМС, полученные реакцией полимеризации
- Качественные реакции
Раздел 11. Техника лабораторных работ
- Знаки техники безопасности
- Мерная посуда
- Лабораторное оборудование для проведения опытов при повышенной температуре
- Получение газов
- Собирание, очистка и осушение газов
- Разделение и очистка твердых веществ. Фильтрование
- Разделение и очистка твердых веществ
- Разделение и очистка жидких веществ
|
Варианты изготовления плакатов на различных материалах:
- Плакат 560х800 мм, полимерная пленка, пластиковая рамка.
Вы можете заказать любое количество печатных плакаты, используя перечень электронных плакатов из комплекта Общая химия.
Комплект типовых плакатов по общей химии:
- Типы химических реакций. Генетическая связь классов неорганических соединений
- Конфигурация атомных орбиталей и ориентация их в пространстве. Строение атомов s-элементов I периода и s- и p-элементов II периода
- Последовательность заполнения атомных орбиталей электронами. Порядок заполнения атомных орбиталей электронами
- Периодическая система элементов Д. И. Менделеева
- Орбитальные радиусы нейтральных атомов, пм. Относительная электроотрицательность атомов элементов по Полингу
- Различные виды σ–связи между атомами А и В. Различные виды π-связи между атомами А и В
Гибридизация валентных орбиталей. Образование гибридных орбиталей в молекулах BeCl2 и BCl3
- Кинетические представления о различных физических состояниях веществ. Энергии некоторых кристаллических решеток (Т = 298 К)
- Строение комплексных соединений. Классификация комплексных соединений по типу лигандов. Изометрия комплексных соединений
- Способы выражения состава растворов. Соотношения между различными способами выражения состава растворов
- Растворимость солей, кислот и оснований в воде (табл. растворимости). Произведения растворимости некоторых малорастворимых электролитов
- Стандартные потенциалы некоторых металлических электродов в водных растворах при 298 К.
- Потенциалы водородного и кислородного электродов при различных условиях
- Классификация органических соединений. Номенклатура органических соединений
- Структурная изомерия. Пространственная изомерия
- Получение газов. Собирание, очистка и осушение газов
- Разделение и очистка твердых веществ. Фильтрование
|