Презентации и плакаты Химия
Цена не включает в себя транспортные расходы и пуско-наладочные работы.
** В связи со сложностью поставок многих комплектующих, цену на товар необходимо уточнять!
Индивидуальный подход
Доставка по РФ и СНГ
Гарантия от производителя
Пуско-наладка при необходимости
Предлагаем заказать учебное оборудование в наличии со склада!
Сопутствующая учебная техника и пособия:
Описание
Комплект учебно-наглядных пособий по Химии включает в себя тщательно проработанный и структурированный графический материал по всему курсу данной дисциплины (169 графических модулей). Дидактические материалы содержат рисунки, схемы, определения и таблицы по Химии и предназначены для демонстрации преподавателем на лекциях. В разработке пособий принимают участие профессора и доценты Южно-Уральского государственного университета, педагогических вузов, а также педагоги-практики с многолетним стажем преподавания. Все иллюстрации выполнены профессиональными художниками.
Возможно несколько вариантов исполнения комплекта учебно-наглядных пособий по Химии:
- Презентации по Химии на CD (электронные плакаты)
- Печатные плакаты (таблицы) по Химии для оформления кабинетов
Диск предназначен для демонстрации преподавателем дидактического материала на занятиях по Химии с использованием интерактивной доски, мультимедийного проектора и прочих компьютерных демонстрационных комплексов. В отличие от обычных электронных учебников для самостоятельного изучения, данные презентации по Химии разработаны специально для показа рисунков, схем, таблиц на лекциях. Удобная программная оболочка имеет оглавление, позволяющее просмотреть необходимый плакат. Предусмотрена защита плакатов от несанкционированного копирования. В помощь преподавателю для подготовки к занятиям прилагается печатное пособие. Ниже представлен состав диска (перечень плакатов) с презентациями по теме Химия.
Перечень плакатов по курсу Химия:
(Кликните для предварительного просмотра или скачайте все)
Раздел 1. Основные понятия химии
- Молярные массы и молярные объемы некоторых веществ
- Разложение воды электрическим током
- Закон сохранения массы вещества
- Генетическая связь классов неорганических соединений
Раздел 2. Строение атома
- Радиоактивное семейство тория-232
- Эксперимент Резерфорда по рассеиванию a-частиц
- «Мысленные» фотографии атома водорода, полученные через равные промежутки времени
- Электронная плотность 1s- и 2s-орбиталей
- Конфигурация атомных орбиталей и ориентация их в пространстве
- Радиальное распределение вероятности нахождения электрона (электронной плотности) на расстоянии r от ядра
- Последовательность заполнения атомных орбиталей электронами
- Порядок заполнения атомных орбиталей электронами
- Строение атомов s-элементов I периода и s- и p-элементов второго периода
Раздел 3. Периодический закон и периодическая система элементов Д. И. Менделеева
- Периодическая система элементов Д. И. Менделеева (табл.)
- Радиусы атомов s-, p-, d-элементов, пм
- Орбитальные радиусы нейтральных атомов
- Зависимость радиуса атома от заряда его ядра
- Энергии ионизации (I) атомов элементов II и III периодов
- Зависимость энергии ионизации (I) от заряда ядра атома
- Сродство к электрону (Еср) атомов некоторых элементов, кДж/моль (табл.)
- Сродство к электрону атомов элементов II и III периодов
- Относительная электроотрицательность атомов элементов по Полингу (табл.)
- Свойства атомов элементов IA и VIIА групп
- Свойства атомов элементов IIIБ, IVБ и IБ групп
- Истинные и эффективные заряды ядер нейтральных атомов (табл.)
Раздел 4. Химическая связь и строение молекул
- Образование химической связи между атомами водорода
- Силы, возникающие при взаимодействии электронов с ядрами двух атомов А и В
- Различные виды σ-связи между атомами А и В
- Различные виды π-связи между атомами А и В
- Гибридизация валентных орбиталей
- Образование гибридных орбиталей в молекулах BeCl2 и BCl3
- Образование иона аммония
- Энергия диссоциации и длина некоторых химических связей (табл.)
- Дипольные моменты некоторых молекул (табл.)
- Распределение вероятности нахождения электронов вдоль межъядерной оси (а, б и в)
- и образование связывающих и разрыхляющих молекулярных орбиталей (б’ и в’)
- Молекулярные σs-орбитали
- Молекулярные σрx-орбитали
- Молекулярные π-орбитали
- Свойства гомоядерных молекул, образованных элементами II периода
- Свойства некоторых молекул и молекулярных ионов, образованных элементами II периода
- Валентные углы и строение молекул водородных соединений элементов VA группы
- Валентные углы и строение молекул водородных соединений элементов VIA группы
- Число локализованных электронных пар (ЛЭП) центрального атома и пространственная конфигурация молекул ABn
- Число локализованных электронных пар (ЛЭП) центрального атома и пространственная конфигурация молекул ABn (продолжение)
- Типы межмолекулярного взаимодействия
- Элементарные ячейки ионных решеток кристаллов NaCl и CsCl
- Ковалентные кристаллы (графит и алмаз)
- Структура кристаллического HF
- Различные типы кристаллической упаковки металлов (трехмерное изображение)
- Структура и свойства твердых веществ
- Строение комплексных соединений
- Изомерия комплексных соединений
Раздел 5. Растворы
- Классификация дисперсных систем (табл.)
- Термодинамика процесса растворения
- Кристаллическая структура льда и структура жидкой воды
- Водородные связи между молекулами воды в кристалле льда
- Зависимость плотности и удельного объема льда и воды от температуры
- Некоторые физические свойства воды в сравнении с другими растворителями
- Зависимость давления насыщеного пара от температуры над чистым растворителем над раствором (C2 > C1)
- Способы выражения состава растворов
- Массовая доля
- Молярная доля
- Молярная концентрация вещества
- Молярная концентрация эквивалентов
- Титр раствора (массовая концентрация)
- Моляльность
- Соотношения между различными способами выражения состава растворов
- Растворимость солей, кислот и оснований в воде (табл. растворимости)
- Состояние сильных и слабых электролитов в растворе
- Растворение и гидратация молекул сахара в воде
- Растворение и диссоциация ионного кристалла
- Растворение, ионизация и диссоциация полярных молекул
- Растворимость некоторых веществ в воде (табл.)
- Кривые растворимости некоторых твердых веществ в воде
- Зависимость растворимости некоторых газов в воде от температуры
- Реакции между ионами в растворах электролитов, идущие с образованием слабого электролита,
- на примере реакции: HCl + NaOH → NaCl + H2O
- Реакции между ионами в растворах электролитов, протекающие с образованием малорастворимого вещества,
- на примере реакции: Na2SO4 + BaCl2→ BaSO4↓ + 2NaCl
- Реакции между ионами в растворах электролитов, протекающие с образованием газообразного вещества,
- на примере реакции: 2HCl + Na2S → H2S↑ + 2NaCl
- Шкала значений pH и окраска некоторых индикаторов
- Ионное произведение воды (КН2О) при различных температурах
- Окраска некоторых индикаторов в различных средах
- Значения pH некоторых растворов (табл.)
- Степень электролитической диссоциации некоторых электролитов (С = 0,1 моль/л) (табл.)
- Константы диссоциации некоторых электролитов (Т = 298 К, С = 0,1 моль/л) (табл.)
- Произведения растворимости некоторых малорастворимых электролитов (табл.)
- Осмотическое давление
- Строение коллоидной мицеллы
- Строение геля и золя
- Эффект Тиндаля
Раздел 6. Окислительно-восстановительные реакции и общие понятия электрохимии
- Степень окисления (СО)
- Распространенные окислители и восстановители
- Метод составления уравнений окислительно-восстановительных реакций (метод электронного баланса)
- Метод составления уравнений окислительно-восстановительных реакций (метод электронно-ионного баланса)
- Гальванический элемент и схема его работы
- Стандартные потенциалы некоторых металлических электродов в водных растворах при 298 К (табл.)
- Схема стандартного водородного электрода. Измерение электродных потенциалов относительно стандартного водородного электрода
- Стандартные потенциалы некоторых окислительно-восстановительных и газовых электродов при 298 К (табл.)
- Виды коррозионных разрушений а) и механизм электрохимической коррозии углеродистой стали в кислой (б,1) и нейтральной (б,2) средах
- Электролиз расплава и водного раствора соли NaCl
Раздел 7. Химическая кинетика и химическое равновесие
- Изменение во времени концентрации реагентов в системе: 2HI ↔ H2 + I2 (Т = 720 К)
- Энергетическая диаграмма разложения перекиси водорода
- Поверхностный слой адсорбента
- Наиболее распространенные катализаторы в гетерогенном катализе
Раздел 8. Химическая термодинамика
- Энергетические диаграммы экзотермической и эндотермической реакций
- Пути превращения исходных веществ в продукты реакции
- Стандартные энтальпии образования (Р = 1 атм., Т = 298 К) (табл.)
- Изменение в степени упорядоченности при растворении ионного кристалла в воде
- Стандартные энтропии некоторых веществ (Р = 1 атм., Т = 298 К) (табл.)
- Стандартные энергии Гиббса (Р = 1 атм., Т = 298 К) (табл.)
- Влияние температуры на самопроизвольное протекание реакций
Раздел 9. Промышленное получение веществ и их применение
- Получение и применение алюминия
- Доменное производство
- Производство стали
- Производство аммиака
- Основные области применения аммиака и азотной кислоты
- Основные области применения фосфора и его соединений
- Основные области применения углерода и его соединений
- Основные области применения кремния и его соединений
- Основные области применения кальция и его соединений
- Основные области применения серы
- Производство серной кислоты
- Основные области применения галогенов и их нахождение в природе
Раздел 10. Органическая химия
- Классификация органических соединений
- Номенклатура органических соединений
- Структурная изомерия
- Пространственная изомерия
- Образование гибридных орбиталей в молекуле CH4
- Предельные углеводороды – алканы (CnH2n+2)
- Циклоалканы (CnH2n)
- Реакция замещения в алканах (SR)
- Образование химических связей в молекуле этилена H2C=CH2
- Непредельные углеводороды алкены (CnH2n)
- Цепной ионный механизм реакции присоединения к алкенам
- Образование химических связей в молекуле бутадиена-1,3
- Диеновые углеводороды (CnH2n–2)
- Образование химических связей в молекуле ацетилена HC ≡ CH
- Непредельные углеводороды алкины (CnH2n–2)
- Образование химических связей в молекуле бензола
- Ароматические углеводороды (CnH2n–6)
- Реакции электрофильного замещения (SЕ) в бензольном ядре
- Заместители I рода и их ориентирующее влияние в реакциях SЕ
- Заместители II рода и их ориентирующее влияние в реакциях SЕ
- Сравнительная характеристика строения и свойств углеводородов
- Спирты
- Механизм реакции нуклеофильного замещения в молекулах спиртов
- Фенолы
- Альдегиды
- Кетоны
- Механизм реакции нуклеофильного присоединения
- Карбоновые кислоты
- Карбоновые кислоты
- Механизм реакции этерификации
- Углеводы
- Углеводы
- Амины
- Аминокислоты
- Свойства аминокислот
- Структура белков
- Гетероциклические соединения
- ВМС, полученные реакцией полимеризации
- Качественные реакции
Раздел 11. Техника лабораторных работ
- Знаки техники безопасности
- Мерная посуда
- Лабораторное оборудование для проведения опытов при повышенной температуре
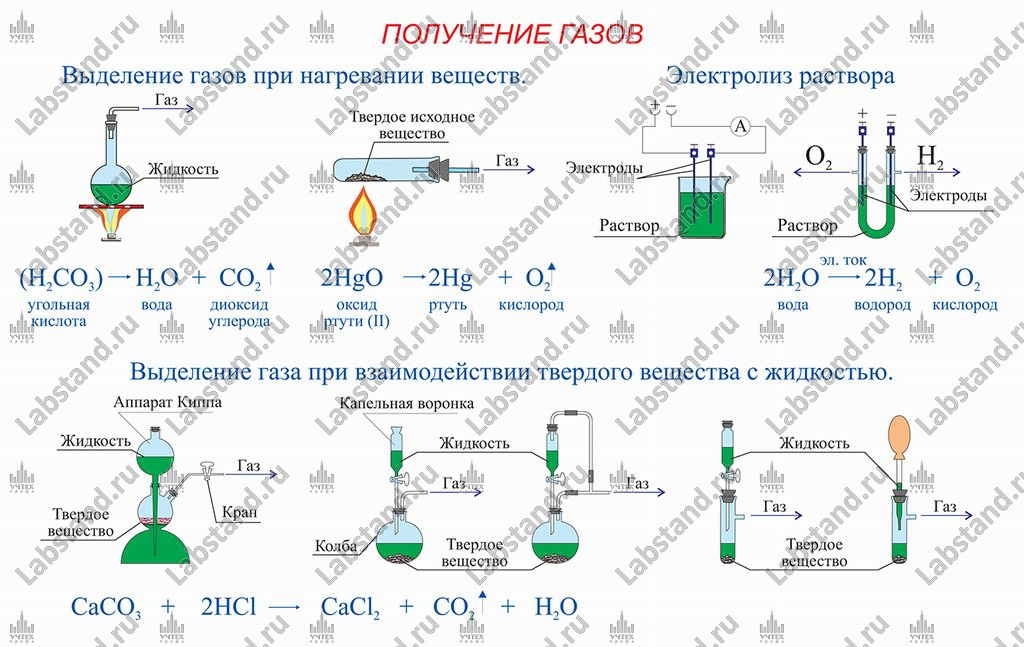
- Получение газов
- Собирание, очистка и осушение газов
- Разделение и очистка твердых веществ. Фильтрование
- Разделение и очистка твердых веществ
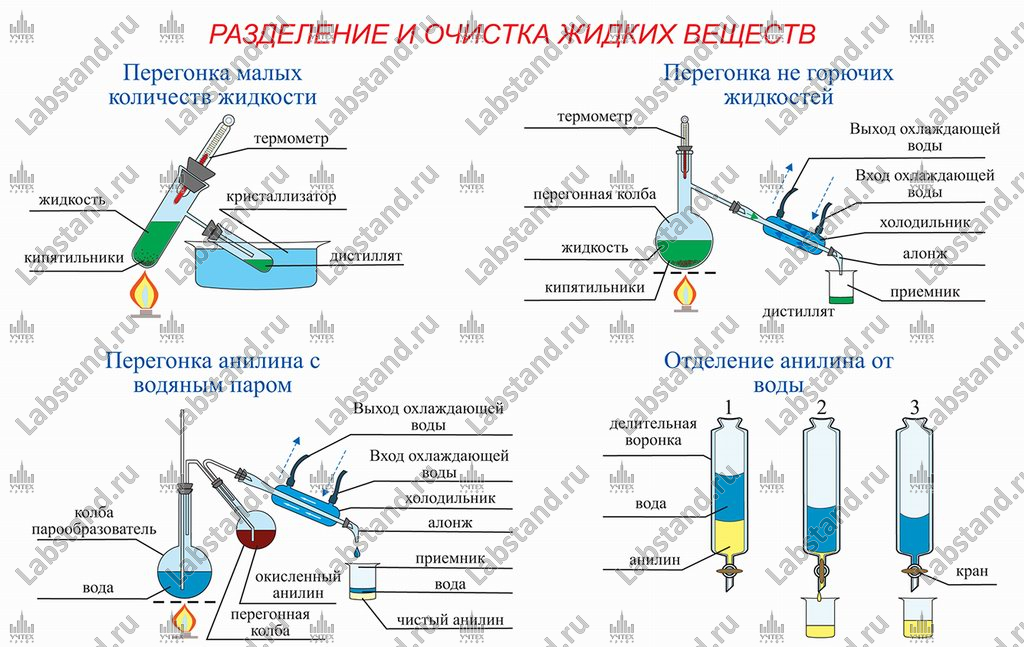
- Разделение и очистка жидких веществ
Печатные плакаты (таблицы) по Химии для оформления кабинетов:
Варианты изготовления плакатов на различных материалах:
- Плакат 560х800 мм, полимерная пленка, пластиковая рамка.
Вы можете заказать печатные плакаты, используя макеты наглядных пособий из комплекта электронных плакатов «Химия» на CD.
Оформление заказа
Купить учебно-наглядные пособия по Химии можно отправив заявку факсом или электронной почтой, а также с помощью нашего интернет-магазина (кнопка «добавить в заявку»). После этого наш сотрудник свяжется с Вами для согласования заказа и выставления счета на оплату. Оплата производится по безналичному расчету. Доставка осуществляется почтой или автотранспортными компаниями в любой регион России и страны СНГ. Доставка до транспортной компании производится бесплатно. Стоимость доставки по России 100-300 руб. в зависимости от региона и способа доставки.
Детали
| Варианты комплектаций | Презентации и плакаты Химия |
|---|